
Năm 2015, thị trường dược phẩm Việt Nam được định giá khoảng 5 tỉ USD. Năm 2020 con số này đã tăng lên khoảng 10 tỉ USD. Theo dự báo của hãng nghiên cứu thị trường IBM, năm 2026, quy mô của ngành dược Việt Nam có thể đạt 16,1 tỉ USD.
Theo Fitch Solutions, trong tổng doanh số thị trường dược phẩm Việt Nam, doanh thu cho kênh ETC (bệnh viện; phòng khám) chiếm 75%; kênh OTC (bán lẻ tại nhà thuốc, quầy thuốc) chiếm khoảng 25%. Chính phủ đã thúc đẩy tỷ lệ bao phủ bảo hiểm y tế toàn dân lên 91% năm 2020; đặt mục tiêu đạt 95% vào năm 2025. Như vậy, chi trả từ BHYT qua kênh ETC sẽ ngày càng chiếm phần lớn trong chi tiêu thuốc.

Việt Nam đặt mục tiêu bao phủ bảo hiểm y tế toàn dân đạt tỷ lệ 95% vào năm 2025 (Ảnh: Thanh Niên)
Luật Dược số 105/2016/QH13 quy định: không chào thầu thuốc nhập khi thuốc sản xuất trong nước đáp ứng yêu cầu về điều trị; giá thuốc và khả năng cung cấp.
Điều 27, thông tư 15/2019/TT-BYT của Bộ Y tế có hướng dẫn về việc lập hồ sơ mời thầu. Theo đó, trong danh mục thuốc sản xuất trong nước có tiêu chuẩn EU- GMP và WHO-GMP đáp ứng yêu cầu về điều trị; giá thuốc và khả năng cung cấp thì không được phép chào thầu thuốc nhập khẩu cho các nhóm 2 và 5.
Thông tư 15 còn quy định về phân chia lại gói thầu và nhóm thuốc đối với thuốc generic. Theo đó, tiêu chuẩn kỹ thuật của các nhóm thầu được nâng cao, thuốc sản xuất trong nước được ưu tiên hơn. Những chính sách này có lợi đối với các doanh nghiệp dược nội địa; có dây chuyền sản xuất đạt tiêu chuẩn EU-GMP. Nguyên nhân là thuốc sản xuất trên dây chuyền đạt chuẩn EU-GMP được xếp vào nhóm đấu thầu số 2 (và nhóm 1 nếu xin được visa xuất khẩu), sẽ là lựa chọn đầu tiên để thay thế thuốc generic ngoại thuộc nhóm 1 và 2.
Bảng tiêu chí phân loại dược phẩm theo nhóm thầu
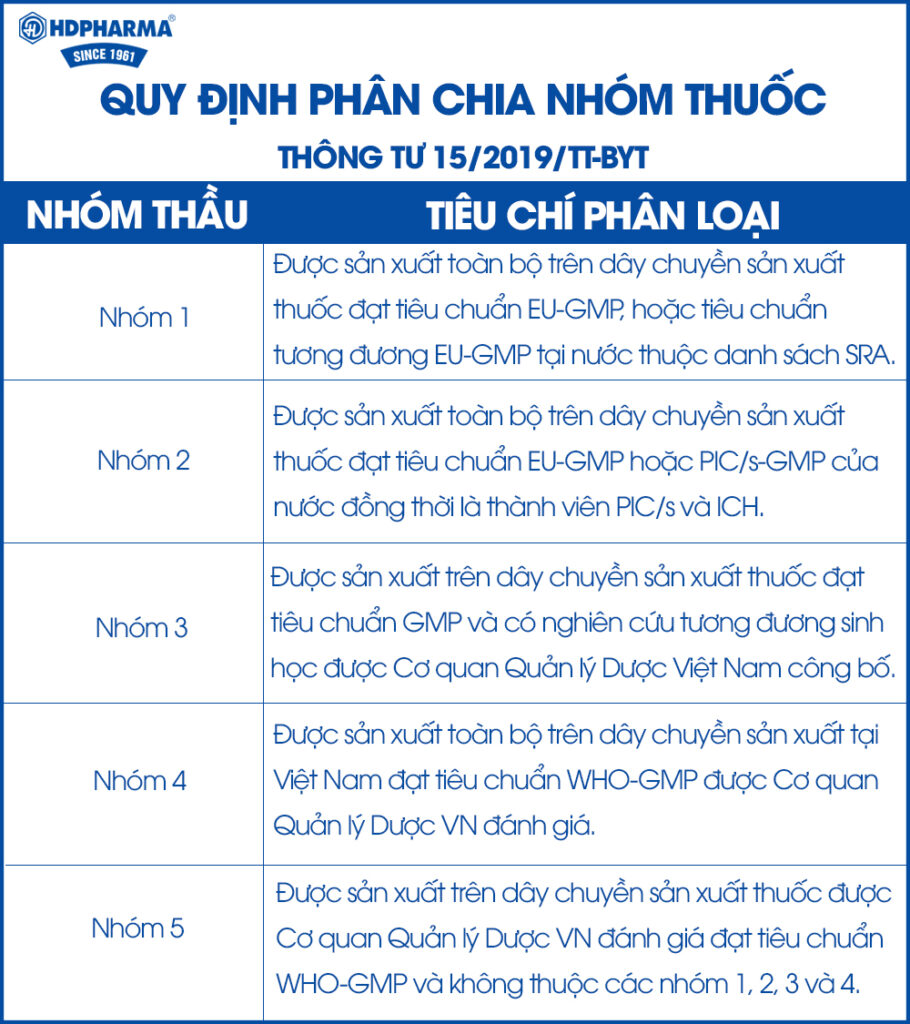
Nguồn: Thông tư 15/2019/TT-BYT, Bộ Y tế
Theo kết quả đấu thầu 2019 – 2020, thuốc sản xuất tại Việt Nam chỉ đáp ứng được hơn 40% nhu cầu thuốc generic. Phần lớn các doanh nghiệp dược Việt Nam đang đấu thầu ở nhóm thuốc 3, 4, 5 ( chỉ yêu cầu tiêu chuẩn WHO-GMP). Hiện tại, thuốc nội chỉ chiếm 3% giá trị trúng thầu thuốc nhóm 1 (tổng giá trị 8.000 tỷ đồng) và 50% giá trị trúng thầu nhóm 2 (tổng giá trị 4.170 tỷ đồng). Đây là 2 nhóm thuốc yêu cầu cơ sở sản xuất phải đạt tiêu chuẩn EU-GMP hoặc PIC/S-GMP.
Nhà máy đạt chuẩn EU-GMP là điều mà các doanh nghiệp dược mong muốn có được. Tuy nhiên, để đầu tư một nhà máy tiêu chuẩn EU-GMP cần rất nhiều thời gian, vốn và chuyên môn. Và lợi thế của các doanh nghiệp đạt chuẩn EU-GMP sẽ khá vững chắc.
Tính đến tháng 8/2022, tại Việt Nam chỉ có 12 cơ sở sản xuất được cấp EU-GMP. Hầu hết các cơ sở này hoạt động tại miền Nam; thuộc những doanh nghiệp có vốn đầu tư nước ngoài. Duy nhất có nhà máy HDPHARMA EU là cơ sở sản xuất dược phẩm đạt chuẩn EU-GMP đầu tiên tại miền Bắc.
EU-GMP trong đấu thầu thuốc tại bệnh viện; phòng khám đang mở ra rất nhiều cơ hội cho doanh nghiệp dược trong nước. Đồng thời, đây còn là tiêu chuẩn giúp người bệnh tiếp cận với thuốc có chất lượng cao; an toàn; và giá cả phù hợp.
HDPHARMA